/
/ - 教室紹介 /
- 研究室紹介
研究室紹介
眼炎症
臨床検体解析によるぶどう膜炎の病態解明と最適化治療に向けた研究
ぶどう膜炎は感染性、自己免疫性、自己炎症性、腫瘍性など多様な疾患群で、同じ疾患の中でもバリエーションが大きく治療への反応や予後が異なることから、ヒト免疫や多様な疾患病態解明の重要性が指摘されています。近年、シングルセル解析や次世代シーケンスなど、限られた臨床検体から多くの情報を得ることが可能な画期的な解析技術が急速に進歩しており、免疫・炎症性疾患研究分野でも応用が進んでいます。眼炎症や治療反応性に関わる要因を明らかにし、診断技術や最適治療の発展に向けて、私達の研究室ではこれらの最新技術を用いたぶどう膜炎眼内液や血液検体の遺伝子、タンパク、細胞レベルの解析を行っています。
これらの研究は全国のぶどう膜炎診療専門機関や専門研究機関との協力体制をつくり、進めています。
Cytometry Time by Flight (CyTOF)を用いたぶどう膜炎検体の同時網羅的解析
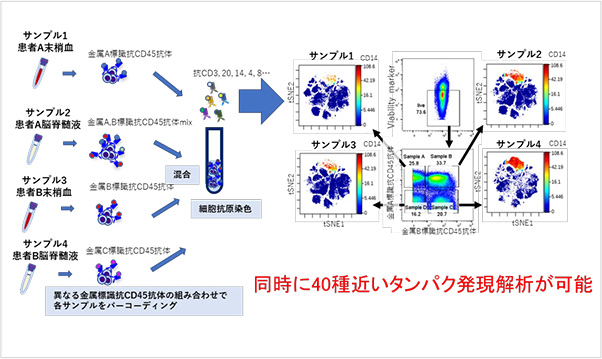
Vogt-小柳-原田病遷延群で頻度の低い末梢血単核球サブセットを見出した
Yamanaら, Mucosal Immunol 2022サイトメガロウイルス感染症眼内液と末梢血中ウイルス遺伝子多型解析
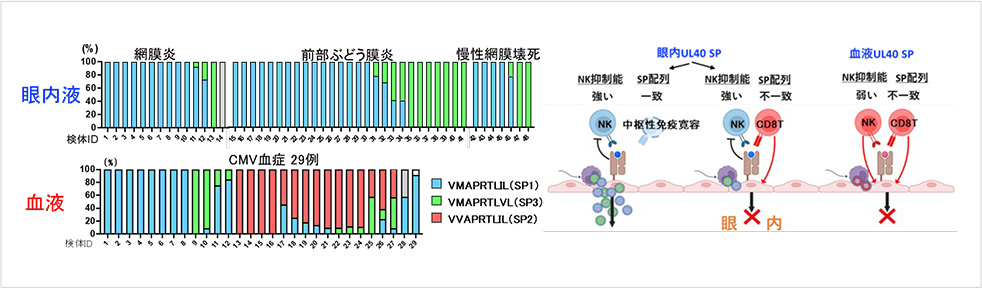
眼内液と末梢血中のウイルス多型分布が異なり、眼内液中のウイルスは高い免役逃避能を持つことが明らかになった
Shiraneら, Front Immunol 2022
ぶどう膜炎における眼炎症細胞の解析と治療応用に向けた研究
自己免疫性ぶどう膜炎に対する治療は、現在ステロイドや免疫抑制薬、生物学的製剤などが用いられております。疾患ごとに使用できる薬剤は異なりますが、以前に比べて治療法は進歩し炎症のコントロールがしやすくなっています。しかし、これらの治療でも効果が乏しく、治療に難渋する症例もあります。そのような症例のためにも新たな治療法の開発は必要であり、日々研究を行っています。
これまでの研究で、我々は自己免疫性ぶどう膜炎に粘膜関連インバリアントT細胞(MAIT細胞)が関連することを発見しました。従来型のT細胞は、多様性に富むT細胞受容体(TCR)を発現し、抗原提示細胞により提示されたペプチドを認識します。それら従来型のT細胞と異なり、 MAIT細胞は単一性のTCRをもつ自然リンパ球の一種で、微生物のビタミンB2前駆体由来の代謝物を認識します。近年ではこのMAIT細胞が自己免疫性疾患、癌、感染症といった様々な病態制御に関わることが明らかになっています。
我々は自己免疫性ぶどう膜炎モデルを用いた実験で、MAIT細胞がぶどう膜炎の炎症抑制効果を有することを明らかにしています。現在はMAIT細胞をターゲットとした新規治療法の開発を目指してさらなる研究を行っています。
実験的自己免疫性ぶどう膜炎モデルを用いたMAIT細胞の炎症抑制効果
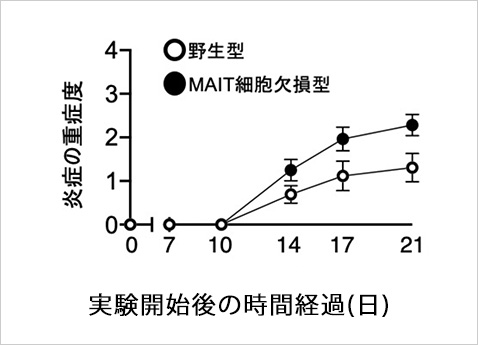
MAIT細胞を欠損させると眼炎症が増悪することが示された。
MAIT細胞活性化によるぶどう炎の炎症抑制効果
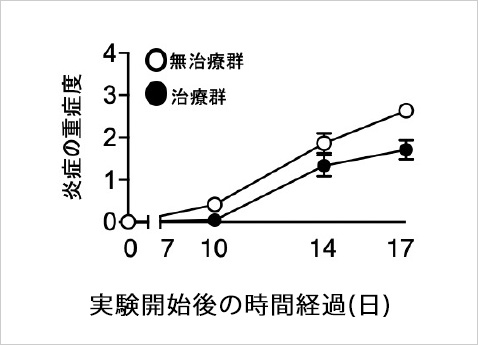
ビタミンB2前駆体由来の代謝物を用いてMAIT細胞を活性化させると眼炎症が
軽減することが示された。
Yamanaら, Mucosal Immunol 2022
Selected publications
- A multicenter study of ocular inflammation after COVID-19 vaccination.
Yasaka Y, Hasegawa E, Keino H, Usui Y, Maruyama K, Yamamoto Y, Kaburaki T, Iwata D, Takeuchi M, Kusuhara S, Takase H, Nagata K, Yanai R, Kaneko Y, Iwahashi C, Fukushima A, Ohguro N, Sonoda KH; JOIS Uveitis Survey Working Group. Jpn J Ophthalmol. 2023 Jan;67(1):14-21. doi: 10.1007/s10384-022-00962-9. - Intraocular human cytomegaloviruses of ocular diseases are distinct from those of viremia and are capable of escaping from innate and adaptive immunity by exploiting HLA-E-mediated peripheral and central tolerance.
Shirane M, Yawata N, Motooka D, Shibata K, Khor SS, Omae Y, Kaburaki T, Yanai R, Mashimo H, Yamana S, Ito T, Hayashida A, Mori Y, Numata A, Murakami Y, Fujiwara K, Ohguro N, Hosogai M, Akiyama M, Hasegawa E, Paley M, Takeda A, Maenaka K, Akashi K, Yokoyama WM, Tokunaga K, Yawata M, Sonoda KH. Front Immunol. 2022 Oct 19; 13:1008220. doi: 10.3389/fimmu.2022.1008220. - Factors associated with low prevalence of Fuchs' uveitis syndrome in Japan.
Yoneda Y, Usui Y, Tanaka R, Hase K, Namba K, Kamoi K, Takase H, Takeuchi M, Matsumiya W, Kusuhara S, Takeda A, Yawata N, Yanai R, Hiyama T, Harada Y, Hashida N, Maruyama K, Nakai K, Taguchi R, Kaburaki T, Mizuki N, Goto H, Fujino Y, Takeuchi M. Front Med (Lausanne). 2022 Sep 30; 9:999804. doi: 10.3389/fmed.2022.999804. - Long-term outcomes of infliximab in patients with Behçet's disease-associated uveitis.
Yamana S, Hasegawa E, Takeda A, Yawata N, Sonoda KH. Int Ophthalmol. 2022 Sep 4. doi: 10.1007/s10792-022-02495-z. Online ahead of print. - Pauveitis induced by donor-derived CD8+ T cells after allogeneic hematopoietic stem cell transplantation for adult T-cell leukemia.
Takeda A, Sakoda T, Yawata N, Kato K, Hasegawa E, Shima T, Hikita S, Yoshitomi K, Takenaka K, Oda Y, Akashi K, Sonoda KH. Am J Ophthalmol Case Rep. 2022 Aug 5; 27:101673. doi:
10.1016/j.ajoc.2022.101673. - Increased vitreous levels of B cell activation factor (BAFF) and soluble interleukin-6 receptor in patients with macular edema due to uveitis related to Behçet's disease and sarcoidosis.
Takeda A, Hasegawa E, Yawata N, Notomi S, Ishikawa K, Murakami Y, Hisatomi T, Kimura K, Sonoda KH.
Graefes Arch Clin Exp Ophthalmol. 2022 Mar 1. doi: 10.1007/s00417-022-05600-1. - Mucosal-associated invariant T cells have therapeutic potential against ocular autoimmunity.
Yamana S, Shibata K, Hasegawa E, Arima M, Shimokawa S, Yawata N, Takeda A, Yamasaki S, Sonoda KH.
Mucosal Immunol. 2022 Feb;15(2):351-361. doi: 10.1038/s41385-021-00469-5. - Takeda A, Hasegawa E, Notomi S, Ishikawa K, Arima M, Murakami Y, Nakao S, Hisatomi T, Sonoda KH. Clin Ophthalmol. 2021 Jun 24; 15:2665-2673. doi: 10.2147/OPTH.S314173.
- Molecular Signatures of Natural Killer Cells in CMV-Associated Anterior Uveitis, A New Type of CMV-Induced Disease in Immunocompetent Individuals.
Yawata N, Shirane M, Woon K, Lim X, Tanaka H, Kawano YI, Yawata M, Chee SP, Siak J, Sonoda KH. Int J Mol Sci. 2021 Mar 31;22(7):3623. doi: 10.3390/ijms22073623. - Epidemiology of uveitis in Japan: a 2016 retrospective nationwide survey. Sonoda KH, Hasegawa E, Namba K, Okada AA, Ohguro N, Goto H; JOIS (Japanese Ocular Inflammation Society) Uveitis Survey Working Group. Jpn J Ophthalmol. 2021 Mar;65(2):184-190. doi: 10.1007/s10384-020-00809-1.
- Vitreous levels of interleukin-35 as a prognostic factor in B-cell vitreoretinal lymphoma.
Takeda A, Hasegawa E, Nakao S, Ishikawa K, Murakami Y, Hisatomi T, Arima M, Yawata N, Oda Y, Kimura K, Yoshikawa H, Sonoda KH.
Sci Rep. 2020 Sep 24;10(1):15715. doi: 10.1038/s41598-020-72962-z. - New insights into immunological therapy for retinal disorders.
Takeda A, Yanai R, Murakami Y, Arima M, Sonoda KH.
Front Immunol. 2020 Jul 3;11:1431. doi: 10.3389/fimmu.2020.01431. eCollection 2020. - Risk factors for failure of vitrectomy cell block technique in cytological diagnosis of vitreoretinal lymphoma.
Ito T, Takeda A, Fujiwara K, Hasegawa E, Nakao S, Ohishi Y, Oda Y, Yoshikawa H, Sonoda KH.
Graefes Arch Clin Exp Ophthalmol. 2019 May;257(5):1029-1036. doi: 10.1007/s00417-019-04266-6. - The effectiveness of adalimumab treatment for non-infectious uveitis.
Hasegawa E, Takeda A, Yawata N, Sonoda KH.
Immunol Med. 2019 Jun;42(2):79-83. doi: 10.1080/25785826.2019.1642080. - Interleukin-6 plays a crucial role in the development of subretinal fibrosis in a mouse model.
Sato K, Takeda A, Hasegawa E, Jo YJ, Arima M, Oshima Y, Ryoji Y, Nakazawa T, Yuzawa M, Nakashizuka H, Shimada H, Kimura K, Ishibashi T, Sonoda KH.
Immunol Med. 2018 Mar;41(1):23-29. doi: 10.1080/09114300.2018.1451609. - Crucial role of P2X7 receptor for effector T cell activation in experimental autoimmune uveitis.
Takeda A, Yamada H, Hasegawa E, Arima M, Notomi S, Myojin S, Yoshimura T, Hisatomi T, Enaida H, Yanai R, Kimura K, Ishibashi T, Sonoda KH.
Jpn J Ophthalmol. 2018 May;62(3):398-406. doi: 10.1007/s10384-018-0587-4. - Cytochrome P450 monooxygenase lipid metabolites are significant second messengers in the resolution of choroidal neovascularization.
Hasegawa E, Inafuku S, Mulki L, Okunuki Y, Yanai R, Smith KE, Kim CB, Klokman G, Bielenberg DR, Puli N, Falck JR, Husain D, Miller JW, Edin ML, Zeldin DC, Lee KSS, Hammock BD, Schunck WH, Connor KM.
Proc Natl Acad Sci U S A. 2017 Sep 5;114(36):E7545-E7553. doi: 10.1073/pnas.1620898114. - Epidemiology of Uveitis, Caused by HTLV-1, Toxoplasmosis, and Tuberculosis; the Three Leading Causes of Endemic Infectious Uveitis in Japan.
Takeda A, Ishibashi T, Sonoda KH.
Ocul Immunol Inflamm. 2017;25(sup1):S19-S23. doi: 10.1080/09273948.2016.1253851. Review.
網膜・線維性増殖
増殖性網膜硝子体疾患の病態解明に基づいた治療法開発
責任研究者;石川 桂二郎
増殖硝子体網膜症や増殖糖尿病網膜症は、眼内の線維性増殖を主病態とする疾患である。治療法は硝子体手術が主であるが、術後の線維性増殖再発により複数回の手術を要し、重症な視機能障害をきたすことがあるが薬物治療が無いのが現状である。また、加齢黄斑変性の末期像である網膜下線維性瘢痕は、現行の抗VEGF療法が無効な病態である。(図1) 申請者らは、それらの増殖性網膜硝子体疾患に伴う線維組織の網羅的な遺伝子発現解析(Ishikawa K et al. FASEB J 2014, IOVS 2015) を基盤とした病態解明研究に取り組み、創薬研究を行ってきた。(図2) このなかで、同定した新規の関連分子であるマトリセルラー蛋白のペリオスチンやテネイシンCの眼内線維増殖における機能的役割を明らかにした。(Kobayashi Y et al. Lab Invest 2016; Ishikawa K et al. FASEB J 2014; Kobo Y et al. Sci Rep. 2020)
-
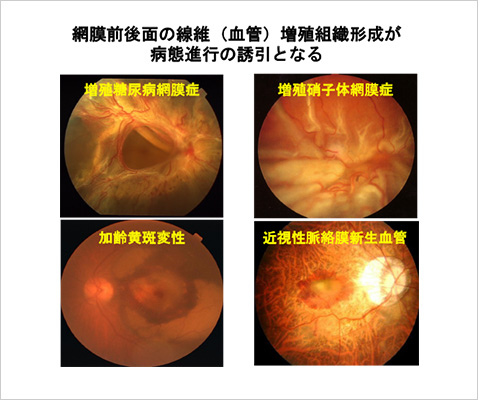
【図1】増殖性網膜硝子体疾患
-
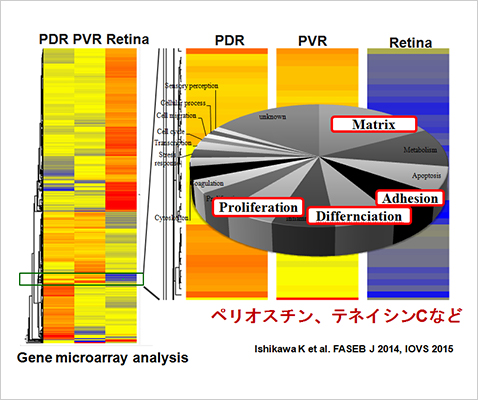
【図2】眼内線維増殖組織の包括的遺伝子解析による病態責任分子の同定
眼内線維増殖組織は、いったん形成されると薬物治療が困難であるため予防的なアプローチが重要となる。我々は、眼内線維増殖の初期段階に重要なステップである細胞の形質転換に着目した。形質転換を制御することにより、ペリオスチンやテネイシンCの発現が抑えられ、増殖網膜症や滲出型加齢黄斑変性の動物モデルにおいて網膜剥離や網膜下線維性瘢痕を抑制できることを明らかにした。(Ishikawa K et al. Sci Rep. 2015; Am J Pathol. 2016)(図3、4)
-
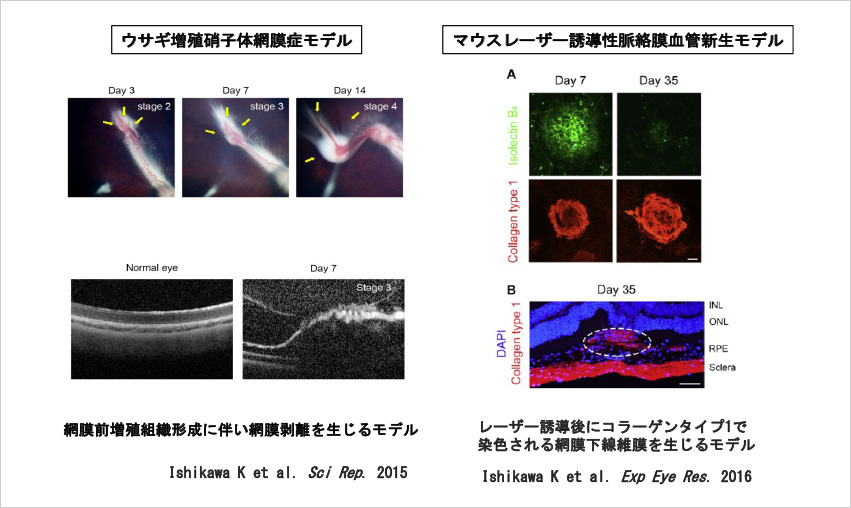
【図3】眼内線維増殖動物モデル
-
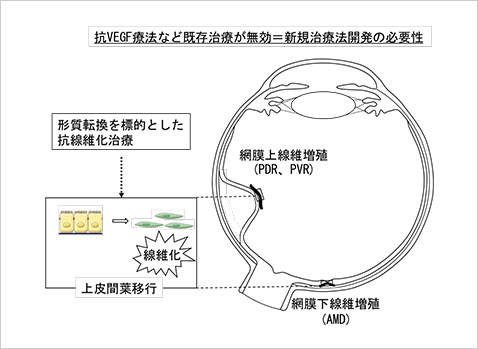
【図4】眼内線維増殖に対する新規治療薬開発
これまでの研究を基盤として、下記の研究課題に取り組んでいる。
- 網膜細胞の形質転換を効率的に抑制する化合物のスクリーニング。実験動物モデルを用いた治療効果の評価。臨床応用を目指した、硝子体内投与後の薬物の眼内動態、安全性の評価。(基礎研究)
- 少ない硝子体内注射による長期的な薬効持続を目指した眼内徐放性ドラッグデリバリーシステムの開発。(基礎研究)
- 広角眼底写真、光干渉断層撮影、光干渉断層血管撮影の解析による眼内線維増殖の早期発見システムの開発。(図5)(臨床研究)
-
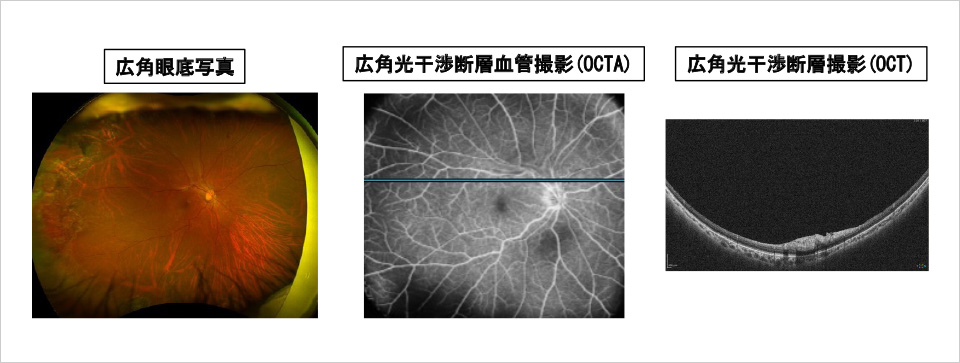
【図5】早期眼内線増殖性変化を捉える画像解析システム開発
Selected publications
- TNFRSF10A downregulation induces retinal pigment epithelium degeneration during the pathogenesis of age-related macular degeneration and central serous chorioretinopathy
Mori K, Ishikawa K, Fukuda Y, Rui ji, Wada I, Kubo Y, Akiyama M, Notomi Shoji, Murakami Y, Nakao S, Arakawa S, Shiose Satomi, Hisatomi T, Yoshida S, Ram Kannan, Sonoda KH;
Hum Mol Genet. 2022/02/01 - Drainage retinotomy confers risk of epiretinal membrane formation following vitrectomy for rhegmatogenous retinal detachment repair
Ishikawa K, Akiyama M, Mori K, Nakama T, Notomi S, Nakao S, Kohno RI,Takeda A, Sonoda KH;
Am J Ophthalmol. 234:20-27, 2021/07/30 - Changes in metamorphopsia after the treatand-extend regimen of anti-VEGF therapy for macular edema associated with branch retinal vein occlusion.
Mori K, Ishikawa K, Wada I, Kubo Y, Kobayashi Y, Nakama T, Masatoshi Haruta, Akiyama M, Nakao S, Yoshida S, Sonoda KH.
PLoS One. 15:10, 2020/10/28 - Periostin and tenascin-C interaction promotes angiogenesis in ischemic proliferative retinopathy.
Kubo Y, Ishikawa K, Mori K, Kobayashi Y, Nakama T, Arima M, Nakao S, Hisatomi T, Haruta M, Yoshida S, Sonoda KH.
Sci Rep. 10(1):9299, 2020/06/09 - Vitrectomy with peripapillary internal limiting membrane peeling for macular retinoschisis associated with normal-tension glaucoma.
Ishikawa K, Fukui T, Nakao S, Shiose S, Sonoda KH.
Am J Ophthalmol Case Rep. 2020 Mar 17;18:100663. - Increased expression of periostin and tenascin-C in eyes with neovascular glaucoma secondary to PDR.
Ishikawa K, Kohno RI, Mori K, Murakami Y, Nakao S, Akiyama M, Yoshida S, Sonoda KH.
Graefes Arch Clin Exp Ophthalmol. 2020 Mar ;258(3):621-628. - Decrease in the number of microaneurysms in diabetic macular edema after anti-vascular endothelial growth factor therapy: implications for indocyanine green angiography-guided detection of refractory microaneurysms.
Mori K, Yoshida S, Kobayashi Y, Ishikawa K, Nakao S, Hisatomi T, Haruta M, Isihibashi T, Sonoda KH.
Graefes Arch Clin Exp Ophthalmol. 2020 Apr;258(4):735-741. - Preoperative estimation of distance between retinal break and limbus with wide-field fundus imaging: Potential clinical utility for conventional scleral buckling.
Ishikawa K, Kohno RI, Hasegawa E, Nakao S, Yoshida S, Sonoda KH.
PLoS One. 2019 Feb 12;14(2):e0212284. - αB-crystallin regulates subretinal fibrosis by modulation of epithelial-mesenchymal transition.
Ishikawa K, Sreekumar PG, Spee C, Nazari H, Zhu D, Kannan R, Hinton DR.
Am J Pathol. 2016;186:859-73. - Molecular mechanisms of subretinal fibrosis in age-related macular degeneration.
Ishikawa K, Kannan R, Hinton DR.
Exp Eye Res. 2016;142:19-25. - Tenascin-C secreted by transdifferentiated retinal pigment epithelial cells promotes choroidal neovascularization via integrin alphaV.
Kobayashi Y, Yoshida S, Zhou Y, Nakama T, Ishikawa K, Kubo Y, Arima M, Nakao S, Hisatomi T, Matsuda A, Sonoda KH, Ishibashi T.
Lab Invest. 2016;96:1178-1188. - Different roles played by periostin splice variants in retinal neovascularization.
Nakama T, Yoshida S, Ishikawa K, Kobayashi Y, Abe T, Kiyonari H, Shioi G, Katsuragi N, Ishibashi T, Morishita R, Taniyama Y.
Exp Eye Res. 2016;153:133-140. - Resveratrol inhibits epithelial-mesenchymal transition of retinal pigment epithelium and development of proliferative vitreoretinopathy.
Ishikawa K, He S, Terasaki H, Nazari H, Zhang H, Spee C, Kannan R, Hinton DR.
Sci Rep. 2015;10;5:16386. - Microarray analysis of gene expression in fibrovascular membranes excised from patients with proliferative diabetic retinopathy.
Ishikawa K, Yoshida S, Kobayashi Y, Zhou Y, Nakama T, Nakao S, Sassa Y, Oshima Y, Niiro H, Akashi K, Kono T, Ishibashi T.
Invest Ophthalmol Vis Sci. 2015;56:932-946. - Periostin promotes the generation of fibrous membranes in proliferative vitreoretinopathy.
Ishikawa K, Yoshida S, Nakao S, Nakama T, Kita T, Asato R, Sassa Y, Arita R, Miyazaki M, Enaida H, Oshima Y, Murakami N, Niiro H, Ono J, Matsuda A, Goto Y, Akashi K, Izuhara K, Kudo A, Kono T, Hafezi-Moghadam A, Ishibashi T.
FASEB J. 2014;28:131-142.
遺伝性網膜疾患
遺伝性網膜変性の治療を実現する!
責任研究者;村上 祐介
遺伝性網膜変性(inherited retinal diseases: IRDs)とは、網膜に発現する分子の遺伝子変異によって起こる網膜変性疾患で、これまでに200種類以上の原因遺伝子が見つかっています。IRDsには網膜色素変性症(retinitis pigmentosa:RP)、錐体ジストロフィー、レーバー先天盲、クリスタリン網膜症など、様々な病状や眼底所見を示す病気が含まれます。ほとんどのIRDsでは治療法がなく、日本の失明原因の第2位となっており、一刻も早い治療開発が必要です。
私たちの研究室では、IRDsの遺伝型(原因遺伝子の種類や変異のタイプ)と表現型(発症年齢や病気の進み方など)の関係を明らかにするとともに、網膜変性のメカニズムを解明することで、遺伝子治療・ナノ粒子医療・新規化合物などの新しい治療法の開発を目指しています。研究のフォーカスの一つは、RPにおける細胞死と神経炎症のメカニズムを明らかにすることです。その成果として、末梢血中の炎症性単球がRPの進行に大きく関与することを発見し、この炎症性単球を抑制するナノ粒子医薬の開発を進めています(図1)。
-
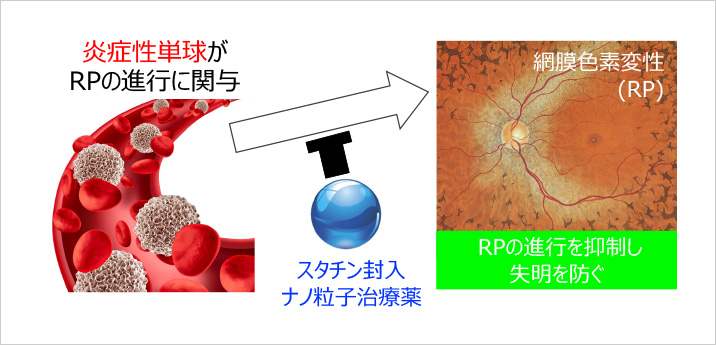
【図1】末梢血の炎症性単球をターゲットとした網膜色素変性に対する治療薬の開発
また遺伝子治療の臨床応用にも取り組んでいます。これまでの基礎研究や臨床研究の成果をもとに、2019年よりRP患者を対象として神経保護遺伝子治療の治験(第1/2a相)を実施中です。この試験では、色素上皮由来因子(PEDF)をコードするレンチウイルスベクターを網膜下腔に注入し、眼内に神経保護因子PEDFを発現させることで、病態の進行を遅らせることを目的としています(図2)。またクリスタリン網膜症に対する遺伝子治療薬の開発も進めています。
-
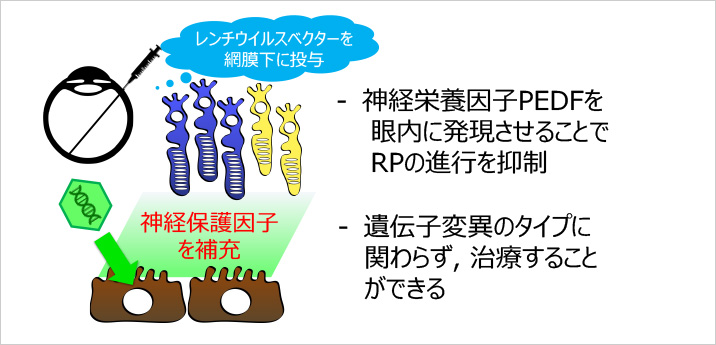
【図2】網膜色素変性に対する神経保護遺伝子治療の開発
Selected publications
- Circulating inflammatory monocytes oppose microglia and contribute to cone cell death in retinitis pigmentosa.
Funatsu J, Murakami Y, Shimokawa S, Nakatake S, Fujiwara K, Okita A, Fukushima M, Shibata K, Yoshida N, Koyanagi Y, Akiyama M, Notomi S, Nakao S, Hisatomi T, Takeda A, Paschalis EI, Vavvas DG, Ikeda Y, Sonoda KH.
PNAS Nexus. 2022 ; 1: pgac003. - Genotype and Long-term Clinical Course of Bietti Crystalline Dystrophy in Korean and Japanese Patients.
Murakami Y, Koyanagi Y, Fukushima M, Yoshimura M, Fujiwara K, Akiyama M, Momozawa Y, Ueno S, Terasaki H, Oishi A, Miyata M, Ikeda H, Tsujikawa A, Mizobuchi K, Hayashi T, Fujinami K, Tsunoda K, Park JY, Han J, Kim M, Lee CS, Kim SJ, Park TK, Joo K, Woo SJ, Ikeda Y, Sonoda KH.
Ophthalmol Retina. 2021; S2468-6530. - Changes of Serum Inflammatory Molecules and Their Relationships with Visual Function in Retinitis Pigmentosa
Okita A, Murakami Y, Shimokawa S, Funatsu J, Fujiwara K, Nakatake S, Koyanagi Y, Akiyama M, Takeda A, Hisatomi T, Ikeda Y, Sonoda KH;
Invest Ophthalmol Vis Sci. 61(11):30, 2020/09/01 - Aqueous Flare and Progression of Visual Field Loss in Patients With Retinitis Pigmentosa
Kohta Fujiwara , Yasuhiro Ikeda , Yusuke Murakami , Takashi Tachibana , Jun Funatsu , Yoshito Koyanagi , Shunji Nakatake , Shotaro Shimokawa , Noriko Yoshida , Shintaro Nakao , Toshio Hisatomi , Tatsuro Ishibashi , Koh-Hei Sonoda Invest Ophthalmol Vis Sci. 61(8):26.2020/7/1 - Innate immune response in retinal homeostasis and inflammatory disorders.
Murakami Y, Ishikawa K, Nakao S, Sonoda KH.
Prog Retin Eye Res. 2020 Jan;74:100778 - Genetic characteristics of retinitis pigmentosa in 1204 Japanese patients.
Koyanagi Y, Akiyama M, Nishiguchi KM, Momozawa Y, Kamatani Y, Takata S, Inai C, Iwasaki Y, Kumano M, Murakami Y, Omodaka K, Abe T, Komori S, Gao D, Hirakata T, Kurata K, Hosono K, Ueno S, Hotta Y, Murakami A, Terasaki H, Wada Y, Nakazawa T, Ishibashi T, Ikeda Y, Kubo M, Sonoda KH.
J Med Genet. 2019 Oct;56(10):662-670. - MUTYH promotes oxidative microglial activation and inherited retinal degeneration.
Nakatake S, Murakami Y, Ikeda Y, Morioka N, Tachibana T, Fujiwara K, Yoshida N, Notomi S, Hisatomi T, Yoshida S, Ishibashi T, Nakabeppu Y, Sonoda KH.
JCI Insight. 2016 Sep 22;1(15):e87781. - Clinical evidence of sustained chronic inflammatory reaction in Retinitis Pigmentosa.
Yoshida N, Ikeda Y, Notomi S, Ishikawa K, Murakami Y, Hisatomi T, Enaida H, Ishibashi T.
Ophthalmology. 2013 Jan;120(1):100-5. - Stable Retinal Gene Expression in Nonhuman Primates via Subretinal Injection of SIVagm-based Lentiviral Vectors.
Ikeda Y, Yonemitsu Y, Miyazaki M, Kohno R, Murakami Y, Murata T, Tabata T, Ueda Y, Ono F, Suzuki T, Ageyama N, Terao K, Hasegawa M, Sueishi K, Ishibashi T.
Hum Gene Ther. 2009 Jun;20(6):573-9. - Simian lentiviral vector-mediated retinal gene transfer of pigment epithelium-derived factor protects retinal degeneration and electrical defect in Royal College of Surgeons rats.
Miyazaki M, Ikeda Y, Yonemitsu Y, Goto Y, Sakamoto T, Tabata T, Ueda Y, Hasegawa M, Tobimatsu S, Ishibashi T, Sueishi K.
Gene Ther. 2003 Aug;10(17):1503-11.
腫瘍・ゲノム
眼科研究室紹介:腫瘍グループ
眼球やまぶたなどに発生する腫瘍は病気になる方の数は多くはなく、専門家の数が限られていることに加えて、基礎研究が進んでいないのが現状です。そこで、我々は眼部悪性腫瘍に対して、病態理解や新しい診断法や治療法の開発のために研究をおこなっています。
- 眼部悪性腫瘍のゲノム解析 悪性腫瘍は、後天的な遺伝子異常により引き起こされます。肺がんなどの様々ながんでは、遺伝子異常について研究が進み、治療法の開発や有効な治療薬の選定に役立てられていますが、眼科領域の悪性腫瘍では、原因が十分に明らかになっていません。また、近年、同じ種類の悪性腫瘍と考えられていたものが、発生する部位によって遺伝子の異常が異なることもわかってきました。 我々は、国内の12施設と共同で眼科領域の悪性腫瘍の遺伝子異常の解明に取り組んでいます。
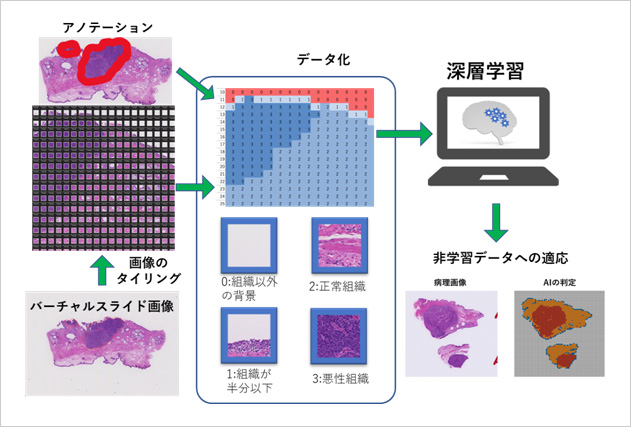
- 眼腫瘍病理の深層学習 眼部腫瘍は希少疾患であり、眼科医だけでなく病理医も目にすることが多くない希少がんです。そこで我々は、病理医師と共同で、手術や診断目的の生検で得られた組織から、A Iを用いてがんの存在を自動的に検出する方法の開発に取り組んでいます。
Selected publications
- High-risk HPV-related Squamous Cell Carcinoma in the Conjunctiva and Lacrimal sac: Clinicopathologic Characteristics and Diagnostic Utility of p16 and Rb Immunohistochemistry Hongo T, Yamamoto H, Tanabe M, Yasumatsu R, Kuga R, Miyazaki Y, Jiromaru R, Hashimoto K, Tateishi Y, Sonoda KH, Nakagawa T, Oda Y; Am J Surg Pathol. 46(7):977-987, 2022/07/01
- Two Cases of Angiosarcoma with Persistent Unilateral Eyelid Swelling
Sakisaka S, Tanabe M, Imayama S, Zeze N, Yamana K, Yoshikawa H, Sonoda KH;
Ocular Oncology and Pathology 8(1):16-21, 2022/02/01 - Defining High-Risk Retinoblastoma: A Multicenter Global Survey
Swathi K, Carol L S, Nathalie C, Francis LM, Guillermo C, Hans EG, Yoshikawa H, Ido Didi F, Jesse LB, John DM, Kahaki K, M Ashwin R, Manoj P, Tanabe M, Furuta M, Natalia G, Patricia Chevez-Barrios, Patricia S, Ralph CE Jr, Riffat R, Rosdali Díaz C, Sadia S, Sandra S, Shahar F, Suzuki S, Tatiana LU, Xunda Ji;
JAMA ophthalmology. 140(1):30-36, 2022/01/01 - Alveolar soft part sarcoma of the orbit: A case report
Oda T, Kikuchi K, Togao O, Baba S, Mizoguchi M, Tanabe M, Itoiu M, Yamamoto H, Ishigami K, Hiwatashi A;
Radiology Case reports. 16:3766-3771, 2021/09/05 - A case of primary orbital solitary fibrous tumor with lung metastases 41 years after initial treatment
Tanabe M, Yoshikawa H, Yuichi Yamada, Yoshinao Oda, Sonoda KH;
Orbit. 10:1-5, 2021/07/14 - Survival and ocular preservation in a long-term cohort of Japanese patients with retinoblastoma.
Ueda T, Koga Y, Yoshikawa H, Tanabe M, Yamana K, Oba U, Nakashima K, Ono H, Ichimura T, Hasegawa S, Kato W, Kobayashi T, Nakayama H , Sakai Y, Yoshitake T, Ohga S, Oda Y, Suzuki S, Sonoda KH, Ohga S
BMC Pediatr. 2020 Jan 28;20(1):37, - Cataracts after Low-Dose Radiotherapy for Lymphoproliferative Disease of the Ocular Adnexa.
Hashimoto S, Yoshikawa H, Miyagi M, Onishi Y, Ohga S, Asai K, Ishibashi T.
Semin Ophthalmol. 2016 Jul 15:1-5. - Clinical Features of Systemic Metastatic Retinal Lymphoma in Japanese Patients.
Taki R, Takeda A, Yoshikawa H, Fukuhara T, Arita R, Suehiro Y, Choi I, Kumano Y, Nakamura T, Ishibashi T.
Ocul Immunol Inflamm. 2016 Apr 12:1-9. - Distinct Profiles of Soluble Cytokine Receptors Between B-Cell Vitreoretinal Lymphoma and Uveitis.
Takeda A, Yoshikawa H, Fukuhara T, Hikita S, Hijioka K, Otomo T, Arita R, Hisatomi T, Kimura K, Yoshida S, Kawano Y, Sonoda KH, Ishibashi T.
Invest Ophthalmol Vis Sci. 2015 Nov;56(12):7516-23. doi: 10.1167/iovs.15-17465. - Ocular surface squamous neoplasia: analysis of 34 cases.
Tanabe M, Yoshikawa H, Onishi Y, Kohno R, Ishibashi T.
Nippon Ganka Gakkai Zasshi. 2014 May;118(5):425-32. Japanese. - A case of Muir-Torre syndrome with multiple cancers of bilateral eyelids and breast.
Kamisasanuki T, Uchino E, Fukushima J, Yoshikawa H, Ishibashi T, Sakamoto T.
Korean J Ophthalmol. 2013 Jun;27(3):204-7. doi: 10.3341/kjo.2013.27.3.204. - A case of metastatic choroidal tumor simulating a choroidal melanoma.
Arima M, Yoshikawa H, Kagimoto T, Kohno R, Ishibashi T.
Jpn J Ophthalmol. 2011 May;55(3):312-4. doi: 10.1007/s10384-011-0015-5. - Congenital simple hamartoma of the retinal pigment epithelium in an Asian.
Gotoh M, Yoshikawa H, Kagimoto HT, Ishibashi T.
Jpn J Ophthalmol. 2008 Mar-Apr;52(2):144-5. doi: 10.1007/s10384-008-0509-y. - Retinal capillary hemangioma managed by transpupillary thermotherapy.
Mochizuki Y, Noda Y, Enaida H, Hata Y, Ueno A, Yoshikawa H, Ishibashi T.
Retina. 2004 Dec;24(6):981-4. - Bilateral epiretinal membranes in nevoid basal cell carcinoma syndrome.
Yoshida S, Yoshikawa H, Yoshida A, Nakamura T, Noda Y, Gondoh H, Fukagawa S, Moroi Y, Urabe K, Furue M, Ishibashi T.
Acta Ophthalmol Scand. 2004 Aug;82(4):488-90. -
Conjunctival keratoacanthoma in an Asian.
Kifuku K, Yoshikawa H, Sonoda KH, Kawano Y, Miyazaki K, Ishibashi T.
Arch Ophthalmol. 2003 Jan;121(1):118-9.
久山町研究
福岡県久山町では60年以上にわたり40歳以上の住民を対象とした前向き追跡調査が行われており、九州大学大学院医学研究院眼科学分野では1998年から久山町研究に参画し、眼疾患に関する疫学研究を開始している。研究目的は、わが国の視覚障害および失明の上位疾患を占める眼疾患の実態を把握し、危険因子、防御因子について解明することである。これまでにも、加齢黄斑変性症、糖尿病網膜症、近視性黄斑症などの眼疾患について調査し、世界に先駆けて重要な疫学的知見を発信している。久山町住民は年齢構成・職業構成が全国平均と一致し、住民の栄養摂取状況も国民栄養調査の成績と変わりないことから、偏りのない日本人の代表的なサンプル集団である。これにより、国民レベルで、効果的・定量的な予防法を構築することにつながり、疾患による視覚障害を早期に予測・発見し重症化を予防することが期待される。
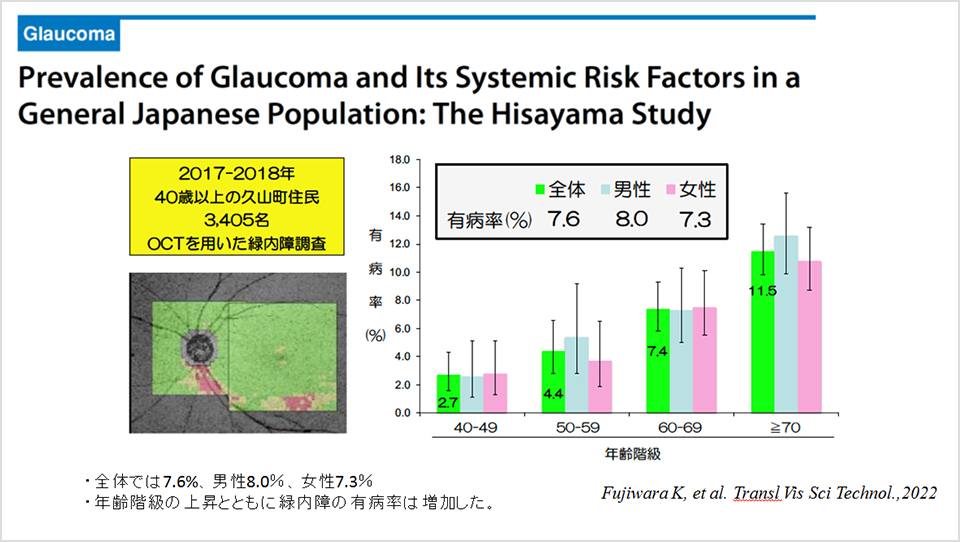
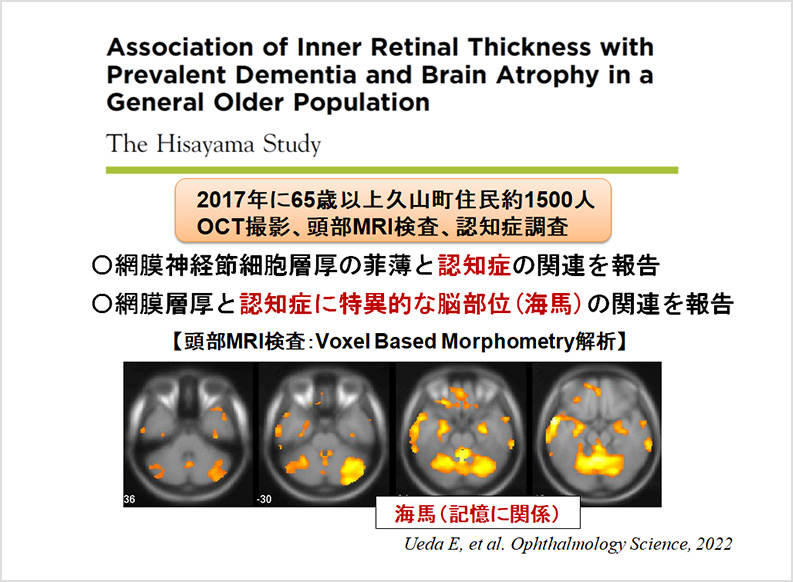
久山町研究では、2017年より日本人視覚障害の第一位である緑内障に注目し、緑内障の疫学調査に着手した。本研究における緑内障健診では従来の疫学研究では用いられていない最新機器を使用することにより、より精度の高い調査を実施した。また、眼科のみに関わらず、内科データも含め全身状態を考慮した包括的な調査も行っている。さらに、新たな試みとして、最近の網膜イメージング技術の目覚ましい進歩に着目し、網膜と脳および認知症の関連についても検討を行っている。このように、久山町研究は、さまざまな疾患について最新かつ精度の高いエビデンスを社会に還元、提供することを目指している。
Selected publications
- Prevalence of glaucoma and its systemic risk actors in a General Japanese Population: The Hisayama Study. Fujiwara K, Yasuda M, Hata J, Nakano S, Hashimoto S, Ueda E, Nakamura S, Murakami Y, Nakamuro T, Iwase A, Araie M, Tawara A, Kubota T, Yoshitomi T, Ninomiya T, Sonoda KH. Transl Vis Sci Technol. 2022;11:11.
- Secular trends in the prevalence, incidence, and progression of diabetic retinopathy: the Hisayama Study Hashimoto S, Yasuda M, Fujiwara K, Ueda E, Nakamura S, Hirakawa Y, Higashioka M, Hata J, Ninomiya T, Sonoda KH; Graefes Arch Clin Exp Ophthalmol. 2022/09/24
- Association of inner retinal thickness with prevalent dementia and brain atrophy in a general olderly population: the Hisayama Study Ueda E, Fujiwara K, Hashimoto S, Nakamura S, Sonoda KH; Ophthalmol Sci . 2(2):100157, 2022/04/19
- The Ganka-Ekigaku Network (GEN), a network of Japanese ophthalmological epidemiology studies.
Sasaki M, Miyake M, Fujiwara K, Nanba H, Akiyama M, Yanagi Y, Harada S, Tabara Y, Yasuda M, Yamashita H, Kayama T, Tsubota K, Matsuda F, Hashimoto S, Ueda E, Ninomiya T, Takebayashi T, Tsujikawa A, Sonoda KH, Kawasaki R:
Cohort Profile: Ophthalmic Epidemiol. 2021 Jun;28(3):237-243. - Five-year incidence of myopic maculopathy in a general Japanese population: the Hisayama Study.JAMA Ophthalmology.
Ueda E, Yasuda M, Fujiwara K, Hashimoto S, Ohno-Matsui K, Hata J, Ishibashi T, Ninomiya T, Sonoda KH.
JAMA Ophthalmol. 2020 Aug 1;138(8):887-893. - Prevalence and Pattern of geographic atrophy in Asia: the Asian Eye Epidemiology Consortium.
Tyler Hyungtaek R, Kawasaki R, Yih-Chung T, Se Woong K, Paisan R, Mukharram M. B, Miyake M, Jie H, Astrid F, Sasaki M, Vinay N, Charumathi S, Marco Y, Fujiwara K, Raba T, Ian Y W, Kayama T, Shih-Jen C, Tung-Mei K, Yamashita H, Periasamy S, Jonathan C. C, G.H. M. B van R, Sonoda KH, Ya Xing W, Songhomitra Panda-J, Sei H, Ramasamy K, Suganeswari G, Rajiv R, Kenji Y, Timur R.G, Watanee J, Kyu Hyung P, Chui Ming G, Tien Yin W, Ningli W, Jost B.J, Usha C, Ching-Yu C, Yanagi Y Ophthalmology. 2020 Oct;127(10):1371-1381. - Trends in the prevalence of myopia and myopic maculopathy in a Japanese population: the Hisayama Study.
Ueda E, Hashimoto S, Fujiwara K, Sonoda KH, Yasuda M.
Invest Ophthalmol Vis Sci. 2019 Jul;1;60(8):2781-86. - Glucose tolerance levels and circumpapillary retinal nerve fiber layer thickness in a general Japanese population: the Hisayama Study.
Fujiwara K, Yasuda M, Hata J, Hirakawa Y, Hashimoto S, Ueda E, Iwase A, Araie M, Yoshitomi Takeshi, Ninomiya T, Sonoda KH. Am J Ophthalmol.
2019 Sep;205:140-6. - Association between axial length and myopic maculopathy: the Hisayama Study.
Hashimoto S, Yasuda M, Fujiwara K, Ueda E, Hata J, Hirakawa Y, Ninomiya T, Sonoda KH.
Ophthalmology Retina. 2019 Oct;3(10):867-73. - Insulin resistance is a risk factor for increased intraocular pressure: the Hisayama Study.
Fujiwara K, Yasuda M, Ninomiya T, Hata J, Hashimoto S, Yoshitomi T, Kiyohara Y, Ishibashi T.
Invest Ophthalmol Vis Sci. 2015 Dec;56(13):7983-7. - Prevalence and risk factors for myopic retinopathy in a Japanese population: the Hisayama Study.
Asakuma T, Yasuda M, Ninomiya T, Noda Y, Arakawa S, Hashimoto S, Ohno-Matsui K, Kiyohara Y, Ishibashi T.
Ophthalmology. 2012 Sep;119(9):1760-5. - Global prevalence and major risk factor of diabetic retinopathy.
Yau JW, Rogers SL, Kawasaki R, Lamoureux EL, Kowalski JW, Bek T, Chen SJ, Dekker JM, Fletcher A, Grauslund J, Haffner S, Hamman RF, Ikram MK, Kayama T, Klein BE, Klein R, Krishnaiah S, Mayurasakorn K, O'Hare JP, Orchard TJ, Porta M, Rema M, RoyMS, Sharma T, Shaw J, Taylor H, Tielsch JM, Varma R, Wang JJ, Wang N, West S, Xu L, Yasuda M, Zhang X, Mitchell P, Wong TY; Meta-Analysis for Eye Disease (META-EYE) Study Group.
Diabetes Care. 2012 Mar;35(3):556-64. - Genome-wide association study identifies two susceptibility loci for exudative age-related macular degeneration in the Japanese population.
Arakawa S, Takahashi A, Ashikawa K, Hosono N, Aoi T, Yasuda M, Oshima Y, Yoshida S, Enaida H, Tsuchihashi T, Mori K, Honda S, Negi A, Arakawa A, Kadonosono K, Kiyohara Y, Kamatani N, Nakamura Y, Ishibashi T, Kubo M .
Nat Genet. 2011 Sep 11;43(10):1001-4. - Nine-year incidence and risk factors for retinal vein occlusion in a general Japanese population: the Hisayama Study.
Arakawa S, Yasuda M, Nagata M, Ninomiya T, Hirakawa Y, Doi Y, Kiyohara Y, Ishibashi T.
Invest Ophthalmol Vis Sci. 2011 Jul;52(8):5905-9. - High serum bilirubin levels and diabetic retinopathy: The Hisayama Study.
Yasuda M, Kiyohara Y, Hata Y, Arakawa S, Yonemoto K, Doi Y, Iida M, Ishibash T.
Ophthalmology. 2011 Jul;118(7):1423-8. - Prevalence and systemic risk factors of retinal vein occlusion in a general Japanese population: The Hisayama Study.
Yasuda M, Kiyohara Y, Hata Y, Arakawa S, Yonemoto K, Doi Y, Iida M, Ishibash T.
Invest Ophthalmol Vis Sci. 2010 Jun;51(6):3205-9. - Nine-year incidence and risk factors for age-related macular degeneration in a defined Japanese population: The Hisayama Study.
Yasuda M, Kiyohara Y, Hata Y, Arakawa S, Yonemoto K, Doi Y, Iida M, Ishibash T.
Ophthalmology. 2009 Nov;116(11):2135-40. - The five-year incidence and risk factors for age related maculopathy in a general Japanese population: the Hisayama Study.
Miyazaki M, Kiyohara Y, Yoshida A, Iida M, Nose Y, Ishibash T.
Invest Ophthalmol Vis Sci. 2005 Jun;46(6):1907-10. - Comparison of diagnostic methods for diabetes mellitus based on prevalence of retinopathy in a Japanese population: The Hisayama Study.
Miyazaki M, Kubo M, Kiyohara Y, Okubo K, Nakamura H, Fujisawa K, Tokunaga S, Iida M, Nose Y, Ishibashi T.
Diabetologia. 2004 Aug;47(8):1411-5.
加齢黄斑変性
加齢黄斑変性におけるリソソーム障害と細胞死メカニズムの解明
責任研究者;納富 昭司
加齢黄斑変性 (Age-related macular degeneration: AMD)は光受容細胞である視細胞が高密度に集中する黄斑という部位に変性が生じる疾患で、中高年における重要な視覚障害の原因です。近年、抗VEGF薬の眼内投与により、後期AMDで生じる脈絡膜新生血管を制御する治療ができるようになりましたが、初期病変として見られる網膜を栄養する網膜色素上皮細胞(RPE)の変性やドルーゼンの蓄積に対しては明確な治療がありません。
ドルーゼンはAMDの初期病変として生じるRPEの基底膜下の沈着物で、脂質や細胞の老廃物を含みます。RPEは光受容を担う網膜視細胞の老廃物を貪食して分解するという役割を担っており、そのリソソーム機能は網膜恒常性維持にとって重要と考えられています(図1)。AMDの最も重要な危険因子は加齢です。我々は加齢により減少するリソソーム膜タンパクLysosome-associated membrane protein 2 (LAMP2)に着目し、AMDにおけるLAMP2の役割を検討しました。
-
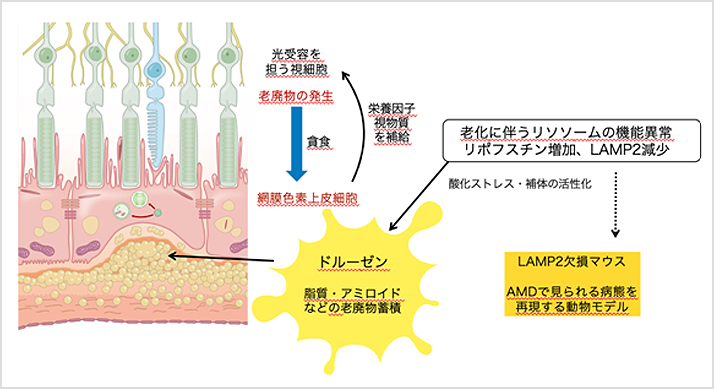
【図1】AMD病態におけるLAMP2およびリソソームの役割
AMD眼標本におけるLAMP2の発現を調べたところ、健常眼では豊富に見られるLAMP2の発現がAMDでは減少していました(Notomi S et al. PNAS 2019)。さらにLAMP2欠損マウスを用いて検討を行ったところ、LAMP2欠損マウスは高齢になるとリポフスチン自発蛍光の増加とともに、ドルーゼンに似た老廃物の蓄積を生じることがわかりました(図2・図3)。これらの結果から、加齢におけるリソソーム障害はAMDの病態を反映する動物モデルになると考えられます。さらに、この動物モデルを用いて、酸化ストレスとの関連や脂質代謝異常についても解析を進めています。
-
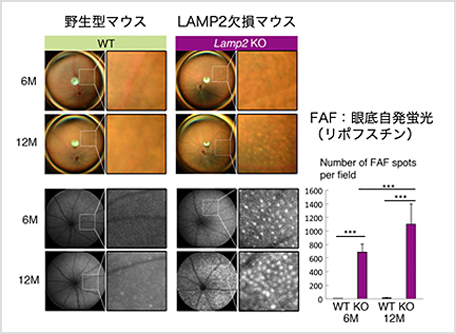
【図2】LAMP2 KOマウスの眼底にリポフスチン顆粒蓄積による著明な自発蛍光の増加を認める
Notomi S et al. PNAS 2019 -
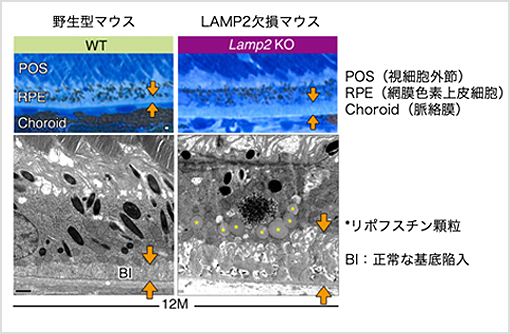
【図3】LAMP2 KOマウスの網膜標本ではRPEの基底膜側にドルーゼン様の沈着物の蓄積を認める。野生型マウスでは正常な基底陥入の構造が見られるのみで、そのような沈着物は全く認めない(矢印)
Notomi S et al. PNAS 2019
加齢黄斑変性における前駆病変の頻度および脈絡膜構造の関与
アジア人におけるAMDでは、ドルーゼンの蓄積だけでなく、色素上皮異常と呼ばれるRPEの変性もよく見られます。近年、光干渉断層計(OCT)の進化により、網膜だけではなくそのさらに深層にある脈絡膜の構造がイメージングできるようになり、アジア人の中心性脈絡網膜症(CSC)やAMDでは、網膜を栄養する脈絡膜の肥厚や血管透過性亢進が重要であることが知られるようになりました。脈絡膜肥厚や血管透過性亢進の特徴は、ギリシア語でPachy- “厚い”、Choroid “脈絡膜”を意味するPachychoroidと呼称されます。
実際に九州大学病院で加療中のAMD患者において、ドルーゼンや色素上皮異常の前駆病変からどのくらい後期AMD(脈絡膜新生血管を伴う滲出型AMD)に移行するか、またそれに伴う脈絡膜肥厚について調査しました。その結果、ドルーゼンと色素上皮異常はともに高い頻度で滲出型AMDになることがわかりました(図4)。脈絡膜の厚みを比較してみると、ドルーゼンと色素上皮異常ではその特徴が真逆で、ドルーゼンのある眼は高齢で脈絡膜が薄いのに対して、色素上皮異常のある眼では脈絡膜が厚いという特徴があることがわかりました(図5)。
-
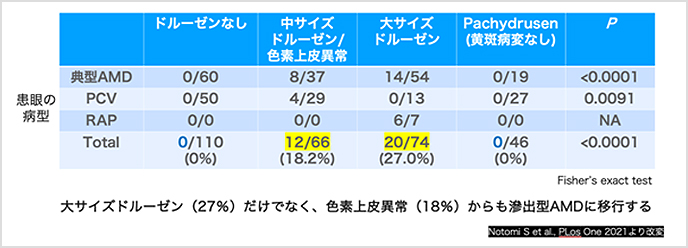
【図4】僚眼における前駆病変の頻度および滲出型AMDの5年発症率(297眼)
-
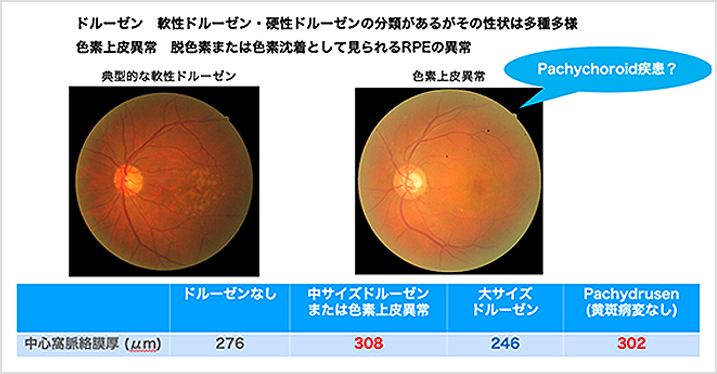
【図5】前駆病変と脈絡膜厚
波長掃引型光干渉断層計(swept-source OCT: SS-OCT)を用いると高速に広い範囲・角度で脈絡膜構造解析ができます。我々は超広角SS-OCT(図6)を用いて、脈絡膜血管の拡張が病態にあるタイプのAMD、いわゆるPachychoroid neovasculopathy(PNV)の脈絡膜厚を解析し、後極部(中心部)と周辺部を比較しました。その結果、PNVは典型AMDやPCVなどの他の病型と比べて、比較的年齢が若い患者が多く、後極部・周辺部どちらとも厚みが増大していることがわかりました。しかし、その比率を検討したところ、特に後極部で脈絡膜肥厚が顕著であることがわかりました(図7)。このような後極部脈絡膜が特に厚いという特徴は中心性脈絡膜網膜症と共通しています。我々の研究結果は、アジア人のAMDはCSCから移行するという最近の報告・仮説を支持するものと考えられます。
-
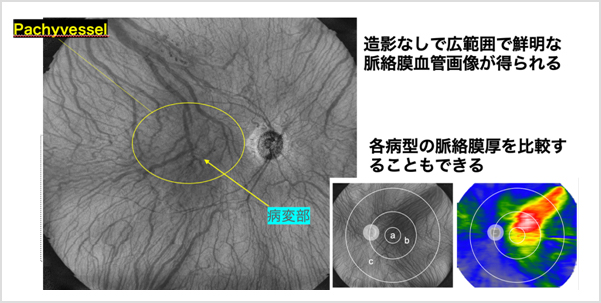
【図6】超広角SS-OCTで見るPachychoroid疾患
-
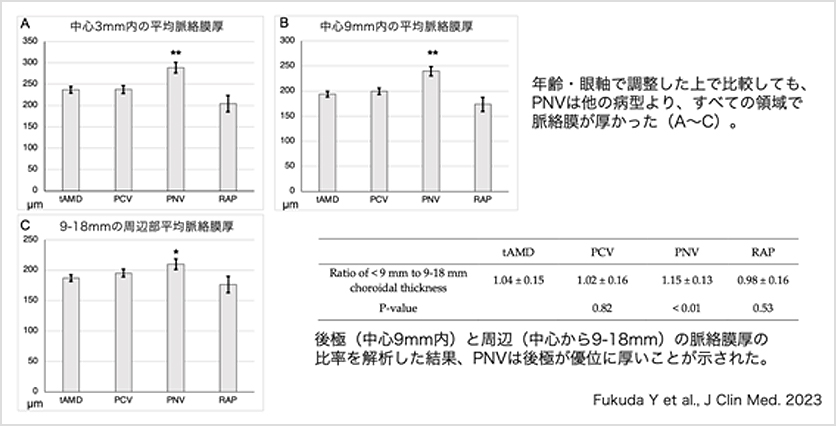
【図7】各病型における脈絡膜厚の比較
このように、実臨床における画像データの解析からAMDの病態に迫る考察を発信したいと考え、大学院生とともに臨床研究を進めています。
Selected publications
- Notomi S et al. Genetic LAMP2 deficiency accelerates the age-associated formation of basal laminar deposits in the retina. Proc Natl Acad Sci U S A. 116(47): 23724-23734 (2019).
- Lee JJ, Ishihara K, Notomi S et al. Lysosome-associated membrane protein-2 deficiency increases the risk of reactive oxygen species-induced ferroptosis in retinal pigment epithelial cells. Biochem Biophys Res Commun. 521(2):414-419 (2020).
- Ueta T, Ishihara K, Notomi S (3rd author) et al. RIP1 kinase mediates angiogenesis by modulating macrophages in experimental neovascularization. Proc Natl Acad Sci U S A. 116(47): 23705-23713 (2019).
- Notomi S et al. Dynamic increase in extracellular ATP accelerates photoreceptor cell apoptosis via ligation of P2RX7 in subretinal hemorrhage. PLOS ONE. 8:e53338 (2013).
- Notomi S et al. Critical involvement of extracellular ATP acting on P2RX7 purinergic receptors in photoreceptor cell death. Am J Pathol. 179:2798 (2011).
- Notomi S et al. Drusen and pigment abnormality predict the development of neovascular age-related macular degeneration in Japanese patients. PLOS ONE. 16(7): e0255213 (2021).
- Notomi S et al. A case of bullous central serous chorioretinopathy treated with surgical removal of submacular fibrin and subsequent photodynamic therapy under silicone oil. Case Rep Ophthalmol. 2022;13:385-392 (2022).
- Notomi S et al. Characteristics of retinal pigment epithelium elevations preceding exudative age-related macular degeneration in Japanese. Ophthalmic Res. 66 (1): 108–115 (2022).
- Fukuda Y, Notomi S et al. Differences in Central and Peripheral Choroidal Thickness among the Subtypes of Age-Related Macular Degeneration in an Asian Population. J Clin Med. 12(16), 5364 (2023).
- Nagata J, Shiose S et al. Clinical characteristics of eyes with neovascular age-related macular degeneration and retinal pigment epithelium tears. J Clin Med. 12(17), 5496 (2023).
- 納富 昭司, 久冨 智朗 【わかりやすい オートファジーと眼疾患】 加齢黄斑変性とオートファジー, 眼科65巻4号 Page 329-336 (2023).
- 納富 昭司 他, 基礎研究コラム リソソームの機能とオートファジー, あたらしい眼科37巻11号 Page 1431 (2020).
- 納富昭司, 久冨智朗 【視細胞疾患の病態と検査】網膜下出血と視細胞障害, 眼科 60巻4号 Page 323-328 (2018).